Šta je titan dioksid?
Glavna komponenta titan dioksida je TIO2, koji je važan neorganski hemijski pigment u obliku bijele čvrste tvari ili praha. Nije toksičan, ima visoku bjelinu i sjaj te se smatra najboljim bijelim pigmentom za poboljšanje bjeline materijala. Široko se koristi u industrijama kao što su premazi, plastika, guma, papir, tinta, keramika, staklo itd.

Ⅰ.Dijagram lanca industrije titanijum dioksida:
(1Uzvodni dio industrijskog lanca titan dioksida sastoji se od sirovina, uključujući ilmenit, titan koncentrat, rutil itd.;
(2Srednji tok se odnosi na proizvode titan dioksida.
(3) Nizvodni tok je područje primjene titan dioksida.Titan dioksid se široko koristi u raznim oblastima kao što su premazi, plastika, proizvodnja papira, tinta, guma itd.

Ⅱ. Kristalna struktura titan dioksida:
Titan dioksid je vrsta polimorfnog spoja koji u prirodi ima tri uobičajena kristalna oblika, a to su anataz, rutil i brukit.
I rutil i anatas pripadaju tetragonalnom kristalnom sistemu, koji je stabilan na normalnoj temperaturi; brukit pripada ortorombičnom kristalnom sistemu, sa nestabilnom kristalnom strukturom, tako da trenutno ima malu praktičnu vrijednost u industriji.

Među tri strukture, rutilna faza je najstabilnija. Anatazna faza će se nepovratno transformirati u rutilnu fazu iznad 900°C, dok će se brookitna faza nepovratno transformirati u rutilnu fazu iznad 650°C.
(1) Titanijum dioksid rutilne faze
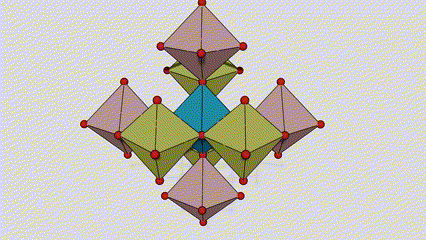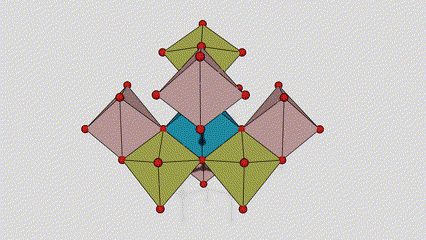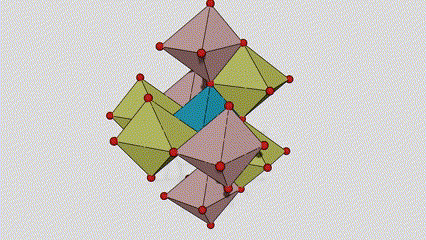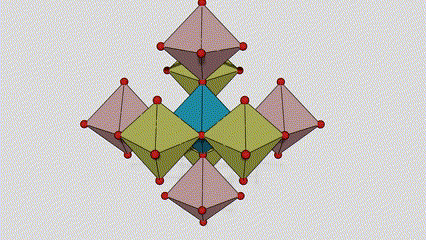
U titan dioksidu rutilne faze, atomi Ti se nalaze u centru kristalne rešetke, a šest atoma kisika se nalazi u uglovima titan-kiseoničkog oktaedra. Svaki oktaedar je povezan sa 10 okolnih oktaedara (uključujući osam zajedničkih vrhova i dva zajednička ruba), a dva molekula TiO2 formiraju jediničnu ćeliju.
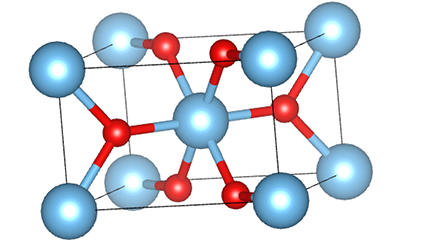
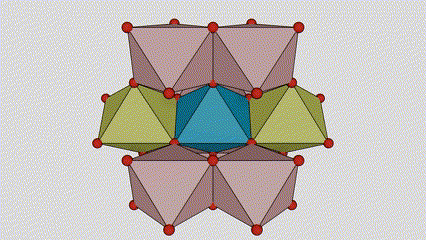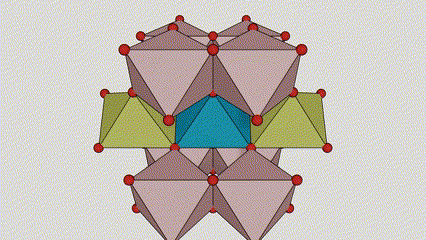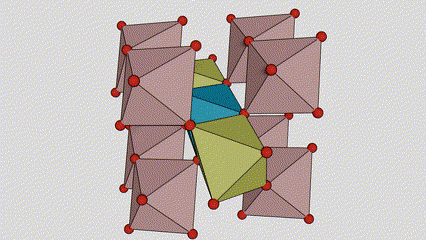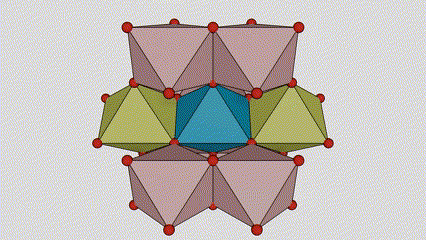
Shematski dijagram kristalne ćelije titanijum dioksida rutilne faze (lijevo)
Metoda povezivanja oktaedra titan oksida (desno)
(2) Titan dioksid u anataznoj fazi
U anataznoj fazi titan dioksida, svaki titan-kiseonikov oktaedar je povezan sa 8 okolnih oktaedara (4 zajednička ruba i 4 zajednička vrha), a 4 molekule TiO2 formiraju jediničnu ćeliju.
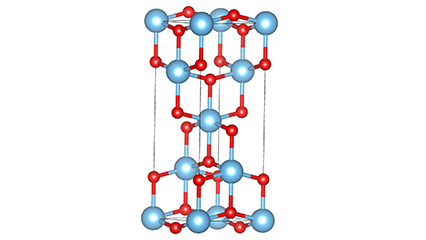
Shematski dijagram kristalne ćelije titanijum dioksida rutilne faze (lijevo)
Metoda povezivanja oktaedra titan oksida (desno)
Ⅲ.Metode pripreme titanijum dioksida:
Proces proizvodnje titan dioksida uglavnom uključuje proces sa sumpornom kiselinom i proces hloriranja.

(1) Postupak sa sumpornom kiselinom
Proces proizvodnje titan dioksida sumpornom kiselinom uključuje reakciju acidolize praha titan željeza koncentriranom sumpornom kiselinom da bi se dobio titan sulfat, koji se zatim hidrolizira da bi se dobila metatitanska kiselina. Nakon kalcinacije i drobljenja dobivaju se proizvodi titan dioksida. Ovom metodom mogu se proizvesti anataz i rutil titan dioksid.
(2) Postupak hloriranja
Proces hloriranja u proizvodnji titan dioksida uključuje miješanje rutila ili praha troske s visokim udjelom titana s koksom, a zatim provođenje hloriranja na visokoj temperaturi za proizvodnju titan tetraklorida. Nakon oksidacije na visokoj temperaturi, proizvod titan dioksida se dobija filtracijom, pranjem vodom, sušenjem i drobljenjem. Proces hloriranja u proizvodnji titan dioksida može proizvesti samo proizvode rutila.
Kako prepoznati autentičnost titan dioksida?
I. Fizičke metode:
(1)Najjednostavnija metoda je upoređivanje teksture dodirom. Lažni titanijum dioksid se osjeća glatkije, dok se pravi titanijum dioksid osjeća hrapavije.

(2)Ispiranjem vodom, ako stavite malo titan dioksida na ruku, lažni se lako ispere, dok se pravi ne ispire lako.

(3)Uzmite šolju čiste vode i u nju ubacite titan dioksid. Onaj koji ispliva na površinu je originalan, dok je onaj koji se slegne na dno lažan (ova metoda možda neće funkcionisati za aktivirane ili modificirane proizvode).
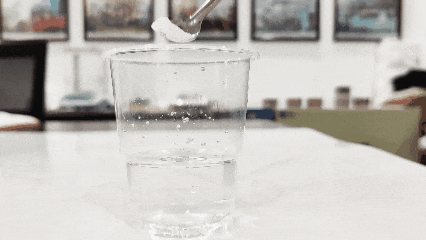

(4)Provjerite njegovu topljivost u vodi. Općenito, titan dioksid je topljiv u vodi (osim titan dioksida posebno dizajniranog za plastiku, tinte i nekih sintetičkih titan dioksida, koji nisu topljivi u vodi).

II. Hemijske metode:
(1) Ako se doda kalcijum u prahu: Dodavanje hlorovodonične kiseline izazvat će burnu reakciju sa škripavim zvukom, praćenu stvaranjem velikog broja mjehurića (jer kalcijum karbonat reaguje sa kiselinom i proizvodi ugljen-dioksid).

(2) Ako se doda litopon: Dodavanje razrijeđene sumporne ili hlorovodične kiseline proizvest će miris pokvarenih jaja.

(3) Ako je uzorak hidrofoban, dodavanje hlorovodonične kiseline neće izazvati reakciju. Međutim, nakon vlaženja etanolom, a zatim dodavanja hlorovodonične kiseline, ako se pojave mjehurići, to dokazuje da uzorak sadrži obloženi prah kalcijum karbonata.

III. Postoje i dvije druge dobre metode:
(1) Korištenjem iste formule PP + 30% GF + 5% PP-G-MAH + 0,5% titan dioksida u prahu, što je niža čvrstoća rezultirajućeg materijala, to je titan dioksid (rutil) autentičniji.
(2) Odaberite prozirnu smolu, kao što je prozirni ABS s dodatkom 0,5% titan dioksida u prahu. Izmjerite njegovu propusnost svjetlosti. Što je niža propusnost svjetlosti, to je titan dioksid u prahu autentičniji.
Vrijeme objave: 31. maj 2024.





